| Et Hydrogen-molekyle består af to Hydrogen-atomer |
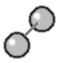 |
| Et Oxygen-molekyle består af to Oxygen-atomer |
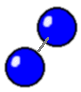 |
| Et vand-molekyle består af to Hydrogen-atomer og et Oxygen-atom |
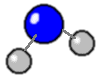 |
Hvis det var muligt atter og
atter at dele en lille portion vand, kunne der dannes så små dråber, at de ikke kunne
ses i mokroskopet. Men ligegyldigt hvor små disse dråber blev, ville de dog stadigvæk
være bygget af ganske små ens smådele, molekyler.
Et vandmolekyle er den mindste enhed, som vand kan opdeles i uden at miste sine
egenskaber.
Alle molekyler består af atomer. Der er godt 100 forskellige atomer, som
kan bindes til hinanden på mange forskellige måder.
Grundstofmolekyler består kun af én slags atomer, mens de kemiske
forbindelsers molekyler indeholder flere slags atomer.
| Et Hydrogen-molekyle består af to Hydrogen-atomer |
 |
| Et Oxygen-molekyle består af to Oxygen-atomer |
 |
| Et vand-molekyle består af to Hydrogen-atomer og et Oxygen-atom |
 |
Vand er ikke et grundstof, men en kemisk forbindelse.
Den kemiske formel for vand er H2O
(H=Hydrogen, O=Oxygen)
Vand dækker ca. 70% af
jordens totale overflade. Vandet gør jorden til en blå planet, som den ses fra rummet.
Næsten alle planter, dyr og mennesker behøver rent vand for at kunne leve et sundt liv.
Alt stof er fast, flydende eller gasformigt. Man taler om de tre tilstandsformer. Det samme stof kan eksistere i alle tre tilstande. Når is opvarmes til 0°C (smeltepunktet), omdannes det til den flydende fase, og når vand opvarmes til 100°C ved 1 atm., omdannes det videre til den gasformige fase (kogepunktet).
En tilfrosset sø, som bliver
opvarmet i vintersolen, kan vise alle tre tilstandsformer på én gang. Fast is på søens
overflade, flydende vand nedenunder, og vanddamp, som stiger op fra isen.
| Fra damp |
Når en gas - som fx vanddamp - afkøles, bliver molekylernes middelhastighed mindre og dermed den kinetiske energi. Sammenstødene mellem molekylerne bliver svagere, og dermed formindskes molekylernes evne til at fjerne sig fra hinanden igen. De fortættes. Når temperaturen bliver tilstrækkelig lav, slår et antal molekyler sig sammen, og vi har da starten til en væske. |
| til vand |
I en væske forsætter molekylernes bevægelse, men den er stærkt begrænset, da molekylerne ligger tættere sammen. Tiltrækningskræfterne fra de andre molekyler er større, og der sker flere sammenstød. |
| til is |
Ved yderligere afkøling, bliver molekylernes middelhastighed endnu mindre. Ved en vis temperatur placeres molekylerne i et bestemt geometrisk mønster. Vi siger at væsken størkner. Molekylerne er dog ikke i hvile i et fast stof, men er bundet til en vibration om en ligevægtsstilling. |
Når vand står i en åben
beholder, vil det efterhånden helt forsvinde op i den blå luft. Vi siger, det er
fordampet. Denne fordampning kan forklares på følgende måde.
Da alle molekyler i væsken ikke har samme hastighed, vil nogle af de hurtigste ved
væskens overflade overvinde tiltrækningskræfterne fra molekylerne i nærheden og gå
over i gasfasen. De vil "hoppe op" i luften.
Da det er de hurtigste
molekyler, der forsvinder, vil middelhastigheden for væskens molekyler falde og dermed
temperaturen i væsken.
I Afrika nedkøler man da også drikkevand ved at sætte en porøs krukke med vand ud i
den brændende sol. En del af vandet fordamper så langsomt gennem krukkens porer, men
resten af vandet afkøles.
I naturen har fordampning og fortætning en stor betydning for de processer, der skaber regnvejr.
Når skolen skinner på en vandoverflade, sker der en fordampning. Da vanddamp er lettere end tør atmosfærisk luft, vil den stige til vejrs. Efterhånden som vanddampen stiger opad, afkøles den, og vil i en højde af ca. 2 km fortættes til det, vi kalder skyer.
Skyerne er altså i
virkeligheden en masse små vanddråber med en diameter fra 0,002 mm til 0,1 mm. Når de
efter yderligere fortætning får en diameter på ca. 2 mm vil de falde tilbage til
jordoverfladen som regn - og et af naturens kredsløb er sluttet.
For de fleste stoffer gælder,
at faste er tungere end flydende. Men de specielle egenskaber ved vand gør det lettere
som fast stof - is flyder på vand! Stærke brint-bindinger, som formes ved frysepunktet
0°C, låser vandmolekylerne lidt væk fra hinanden. Når is smelter, kollapser strukturen
og molekylerne bevæger sig nærmere hinanden. Flydende vand ved 4°C er omkring 9%
tungere end is. Denne egenskab spiller en vigtig rolle i økosystemer som søer og
oceaner. Flydende is isolerer ofte og beskytter derved de dyr og planter, som lever i
vandet under isen.

Der kræves en masse energi for at kunne hæve vandtemperaturen fra frysepunktet til kogepunktet. Faktisk fem gange mere end for sand. Derfor er sandet ofte brændende varmt at gå på en varm sommerdag, mens havvandet kun er lidt opvarmet.
Energi frigøres når vand
fryser. Nætter når isen fryser, føles derfor ofte varmere end nætter, hvor isen
smelter.
Vandmolekyler på overfladen holdes så tæt sammen, at der dannes en usynlig film. Vandets overfladespænding kan bære en vægt, som normalt ville synke. Du kan forsigtigt lægge nogle clips på et stykke alufolie på toppen af vandet i et glas.
Overfladespændingen tillader
mange insekter, som edderkopper og skøjteløbere, at kunne gå på vandet over søer og
åer. Sammen med kviksølv har vand den højeste overfladespænding af alle almindeligt
forekommende væsker.
Forskere kalder ofte vand for
et "universal-opløsningsmiddel", fordi vand kan opløse flere stoffer end andre
væsker.
Allerede for 3000 år siden forstod man i Østen og Ægypten at udnytte den energi, der kunne være i strømmende eller dæmninger. Ved hjælp af vandmøller kunne vandets energi overføres til pumper, kværne og save.
Ved opfindelsen af vandturbinen, der trækker store generatorer, blev denne måde at skaffe energi sig på forbedret betydeligt. En af verdens største kunstige søer blev skabt i 1970 i Ægypten, da man byggede Asswandæmningen over Nilen. Dæmningen er 3,6 km lang og 11 m høj. Der blev bygget et el-værk med 12 turbiner, og Ægyptens dyrkede areal blev forøget med 20%, fordi det blev muligt at lede vand ud i ørkenområderne.
I Danmark er der også bygget vandkraftværker. Tangeværket ved Gudenåen og Karlsgårdeværket
ved Varde Å er de største.
[ Viden om vand |
Undersøgelse af vand ]
[ kystarkiv.dk ]